-
脑科学是21世纪最重要的前沿科学之一。脑组织是生物体结构最复杂的器官,而其功能衍生于结构,想要深入了解大脑发育和神经退行性疾病发展过程中的生理功能及其作用机制,必须高分辨解析活体脑组织结构信息。其中阿尔茨海默症(Alzheimer’s disease, AD)是最常见的慢性神经退行性疾病,其特点是进行性记忆衰退,随后出现更广泛的认知功能丧失[1]。2019年,世界上有5000多万人患有痴呆症,到2050年,这一数字将增加到1.52亿,其中三分之二是AD型痴呆症。目前,痴呆症的年成本估计为1万亿美元,到2030年将翻一番,阿尔茨海默病已成为老年人致残和死亡的第三大原因,仅次于心脑血管疾病和恶性肿瘤[2]。然而,AD详细的发病机制至今仍不清楚,越来越多的证据承认AD是一种多因素和异质性的疾病,其病理涉及多种因素,包括β淀粉样蛋白(amyloid-β peptide, Aβ)、Tau蛋白、胆碱能神经元损伤和氧化应激、炎症,血脑屏障完整性和脑血流的改变等[3]。脑结构和脑功能影像技术是研究AD发病机制的重要工具,如临床上使用的X光计算断层扫描术(X-ray computed tomography, CT)、结构和功能的磁共振成像(magnetic resonance imaging, MRI)和正电子发射断层扫描(positron emission tomography, PET)技术,可以显示出AD患者大脑中特征性变化,甚至在症状前帮助确定AD的发展过程进而进行干预,但大型化或时间空间分辨率限制了以上影像方法在研究AD发病机制上的应用[4]。与临床成像方式相比,光学成像方式具有无创、灵敏度高、成本低、成像速度快、可进行高空间和时间分辨率的三维成像等诸多优势,但受光学散射的影响,成像深度限制了它的应用范围[5]。由于脑组织的复杂性和AD疾病涉及不同的时空范围,空间上从纳米大小的突触到米级别的神经纤维,时间上从毫秒间隔的神经电信号和几十年的记忆存储,没有一种单一的成像方法可以单独提供所有相关信息,但多种影像技术互补的智能组合可以有效,配合多种影像技术可以实现亚细胞空间分辨率到全脑的即时成像。其中光声成像的分辨率和成像速度使其成为神经科学影像中必不可少的一部分。
光声成像作为一种新兴的生物医学影像技术,在近十年内得到了广泛的研究和进展[6-10]。光声成像是一种利用生物体内源或外源性分子吸收激光能量产生热弹性膨胀,把组织的光吸收信息转化为超声信号的影像技术[11-14],它具备光学成像的高对比度和超声成像的深穿透性,有潜力发展成为一种针对脑组织的神经科学影像技术。
文中利用光声成像技术从脑组织切片、离体全脑组织和活体脑组织三个层面对APP/PS1转基因AD模型小鼠和野生型WT小鼠的脑结构变化和脑血管网络进行了成像。对比WT鼠与AD鼠的光声成像结果发现,在大脑皮层区域AD鼠显示了更多的异质性结构。活体光声血管成像显示,AD鼠相比于同年龄段的WT鼠血管网络更加紊乱,血管破裂现象严重。文中通过对AD鼠脑组织和血管网络的成像,证明了光声成像可以在活体或离体组织方面表征AD鼠脑结构和血管网络的变化,有潜力发展为一种脑科学研究的有力影像工具,为脑类疾病病理的发展提供更深入的见解。
-
生物组织中的吸收体受到脉冲激光辐射时,基态分子吸收光子能量跃迁到激发态,发生非辐射跃迁产生的热能使吸收体温度升高,发生热弹性膨胀,继而产生光声信号。被体外的超声探测器捕获后重建出的光声成像能反映生物体内吸收体的空间分布。其中产生的光声信号振幅可以表示为[15]:
$$ p = I\mu {\eta _{{\rm{th}}}}\varGamma $$ 式中:
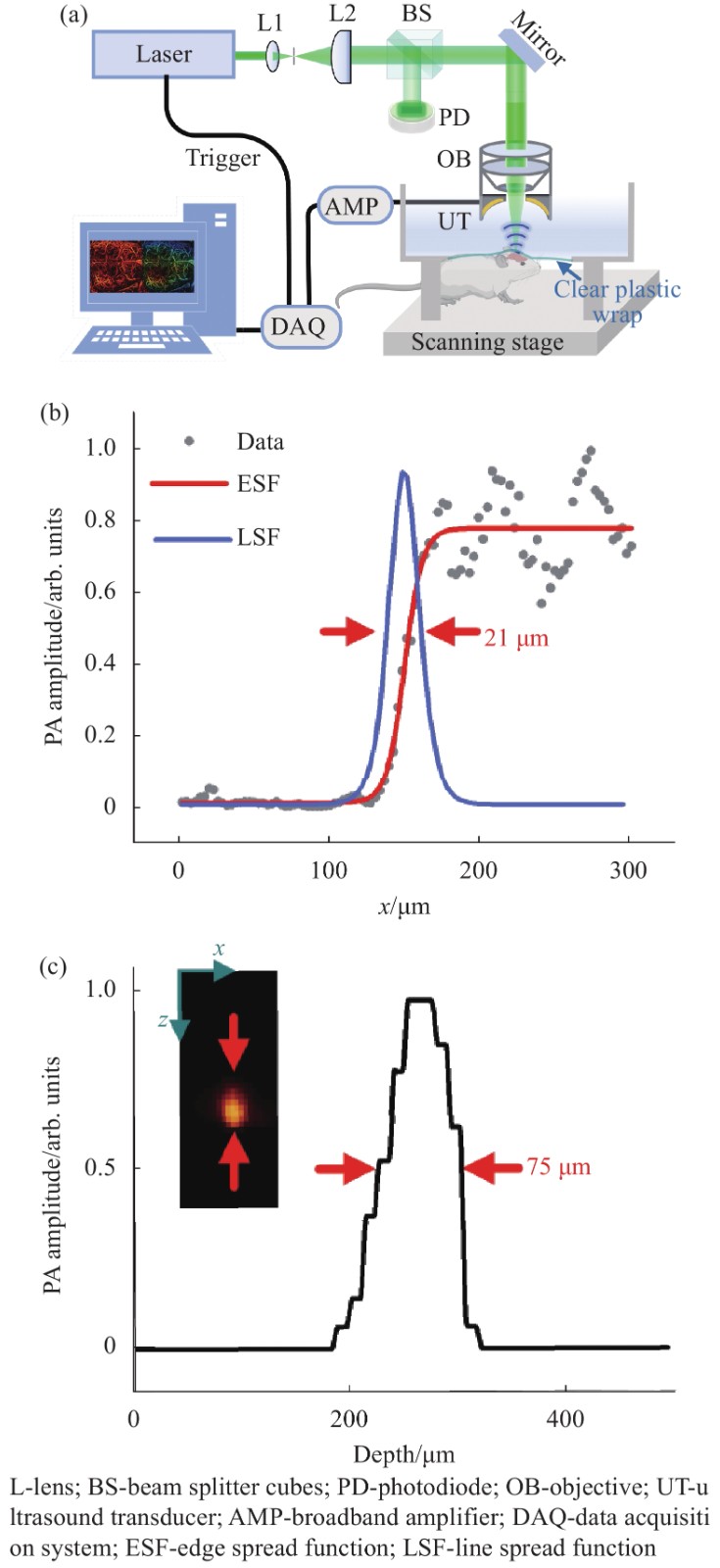
$I$ 为激发光的光强;$\;\mu $ 为组织的光吸收系数;${\eta _{{\text{th}}}}$ 为热转换效率;$\varGamma$ 为 Grueneisen 参数,与组织的弹性模量和比热容有关。脉宽为纳秒或皮秒的短脉冲激光作为激发源时,单发脉冲持续的时间远远小于生物组织的热弛豫时间,此时热量被禁闭在光照范围之内,即满足热禁闭条件,吸收体会产生瞬间温升,产生波前速度更大的热弹波,使得伴随产生的光声信号振幅增强。所以选择的激发光源的脉宽在纳秒级别,以保证更高的信号转化效率。所提出的光声成像系统装置如图1(a)所示,其中激光器的波长为532 nm,脉宽为10 ns,实验时利用的重复频率为10 kHz (DTL-314QT, 脉冲调Q,俄罗斯)。激光先经过空间针孔滤波系统滤掉杂散光,再经过分束棱镜(BS)分成两束光,其中一束光作用于光电二极管用于监控激光能量,另一束光经过物镜(NA=0.1)聚焦到样品表面,产生的光声信号被自制的中空聚焦换能器(UT,中心孔直径为3 mm,焦距为8 mm,中心频率为30 MHz,100%带宽)接收,然后再通过信号放大器(AMP, LNA-650, RF BAY)被高速采集卡(DAQ, M3 i.4110)采集,结合二维扫描平台和Matlab软件重建出样品相应的光声成像。

图 1 (a)光声成像系统装置图;(b)系统横向分辨率;(c)系统轴向分辨率
Figure 1. (a) Photoacoustic (PA) imaging system experimental setups; (b) System lateral resolution; (c) System axial resolution
实验系统的横向分辨率是通过成像锐利的手术刀锋边缘来测量的。通过扫描锐利刀锋边缘得到光声信号的边缘扩散函数(ESF),进一步求导得到线扩散函数(LSF),最后测得系统横向分辨约为20 μm,如图1(b)所示。轴向分辨率的测量通过对直径为20 μm的钨丝进行x-z截面成像得到,如图1(c)所示,系统的轴向分辨率约为75 μm。在实验过程中,系统的电动平移台 (LS2-25T, 简成光电,中国)快轴速度设置为10 mm/s,慢轴的步距为10 μm,所以扫描10 mm×10 mm的成像区域所需时间大约为16.7 min,后续可以提高激光的重复频率,实现更快的成像速度。
-
文中3组实验涉及到的6只小鼠,通过尾活检标本的聚合酶链反应(PCR)分析确定基因型。该研究以具有AD病理特征的APP/PS1转基因小鼠和非转基因WT同窝鼠为对照。实验小鼠均为C57BL/6背景,非转基因WT和APP/PS1转基因AD小鼠同窝巢配对,饲养条件相同。3组实验进行时,6只小鼠的鼠龄均为10个月左右。
-
对AD鼠和WT鼠脑组织切片进行了光声成像,结果如图2所示。在成像之前,将10月龄AD小鼠和WT小鼠的脑组织完整取出,用4%多聚甲醛固定(4 ℃,12 h),然后再用15%蔗糖溶液脱水(4 ℃,12 h),最后浸泡在30%蔗糖溶液中(4 ℃,12 h)。由于光声成像对组织切片厚度没有要求,实验中直接用手术刀沿冠状面(图2(a)上面图中蓝色虚线位置)冠状面切开固定脱水后的脑组织,切开后的脑组织冠状切面如图2(a)下方图所示。把切开后的脑组织利用琼脂固定,放在装有PBS缓冲液(磷酸缓冲盐溶液)的水槽中,进行光声成像。图2(a)中显示,AD鼠和WT鼠的脑冠状切面对应的位置有所差异,经对照小鼠脑图谱[16]确定两者虽然不在同一位置,但相差的距离大约在0.5 mm左右,对于对比AD和WT鼠大脑皮层区域的结构而言影响不大。
光声成像结果如图2(b)所示,可以看出,AD鼠脑皮层区域和WT鼠脑皮层区域的光声成像存在明显的差异,WT鼠脑皮层光声成像结果更加均匀平滑,而AD鼠脑皮层区域存在更多异质性结构。对两者脑皮层区域的光声信号幅值的分布进行统计如图2(c)、(d)所示,结果显示:WT鼠脑皮层的光声信号幅值大小分布范围窄,并且值较小;而AD鼠脑皮层的光声信号幅值分布更加广泛,且数值较大。结合有关AD病理特征[17],这种差别应该来源于AD鼠的大脑皮层区域发生了慢性炎症或淀粉样斑块的沉积导致脑结构异质化,在光声成像中表现为吸收不均匀,出现更多斑点区域。通过图2的结果表明,光声成像能在脑组织切片层次反映AD鼠脑结构的异质性。
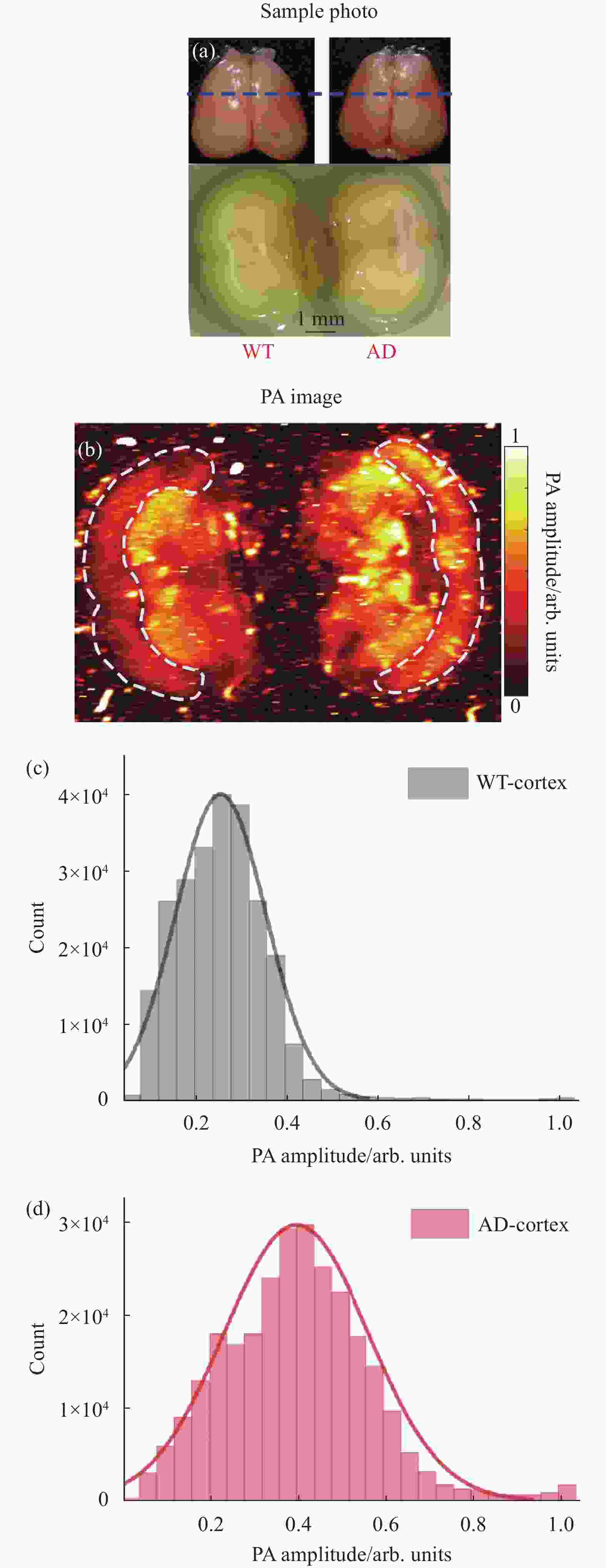
图 2 (a) WT鼠和AD鼠大脑组织和脑冠状切面的光学照片(蓝色虚线标注了冠状切面所在位置);(b) WT鼠和AD鼠脑组织冠状切面的光声成像;(c) WT鼠脑皮层区域光声信号幅值分布统计图;(d) AD鼠脑皮层区域光声信号幅值分布统计图
Figure 2. (a) Optical photographs of WT and AD rat brain tissue and coronal sections (blue dashed lines indicating the location of the coronal section); (b) Coronal PA imaging of WT and AD mice brain; (c) Statistical graph of amplitude distribution of PA signal in cortex of WT mouse; (d) Statistical graph of amplitude distribution of PA signal in cortex of AD mouse
-
取经过固定和脱水后的WT鼠和AD鼠的完整脑组织直接进行光声成像,成像结果如图3所示。图3(a)为全脑组织的光学照片,图3(b)为光声成像的结果,可以发现AD鼠的大脑区域光声信号幅值比WT鼠相应区域的信号幅值偏大,特别是右脑区域。图3(c)是沿图3(a)中蓝色虚线位置的冠状面成像结果,成像的深度在~1 mm,刚好能覆盖小鼠模型的脑皮层区域,图中箭头指向区域的光声信号幅值相比其他位置有明显的异质性。图3(d)展现了在深度为0.6 mm位置横断面的光声成像结果,可以很明显地分辨出在AD鼠的右脑区域存在多个异质结构,这与AD的发展特征一致。在AD疾病的发展过程中,大脑皮层区域会率先出现β-淀粉样蛋白的异常聚集,形成斑块,这些斑块聚集在神经元之间并破坏细胞功能,接着在斑块的周围神经胶质细胞的积聚引发慢性炎症,进一步损害神经元并改变脑结构[18]。通过对比AD/WT鼠脑成像结果,可以得到AD鼠病情发展过程中其脑结构发生了改变,并且光声成像可以识别到这些异常化的结构区域。

图 3 (a) WT鼠和AD鼠脑组织的光学照片;(b) WT鼠和AD鼠脑组织的光声成像;(c) WT鼠和AD鼠脑组织沿图(a)蓝色虚线位置的冠状面光声成像;(d) WT鼠和AD鼠脑组织深度为0.6 mm处横断面光声成像
Figure 3. (a) Optical photograph of brain tissue of WT and AD mice; (b) PA imaging of WT and AD mice brain tissue; (c) Coronal PA imaging of WT and AD mice brain tissue along the blue dotted line in (a); (d) Transverse PA imaging at a depth of 0.6 mm in WT and AD mouse brain tissue
-
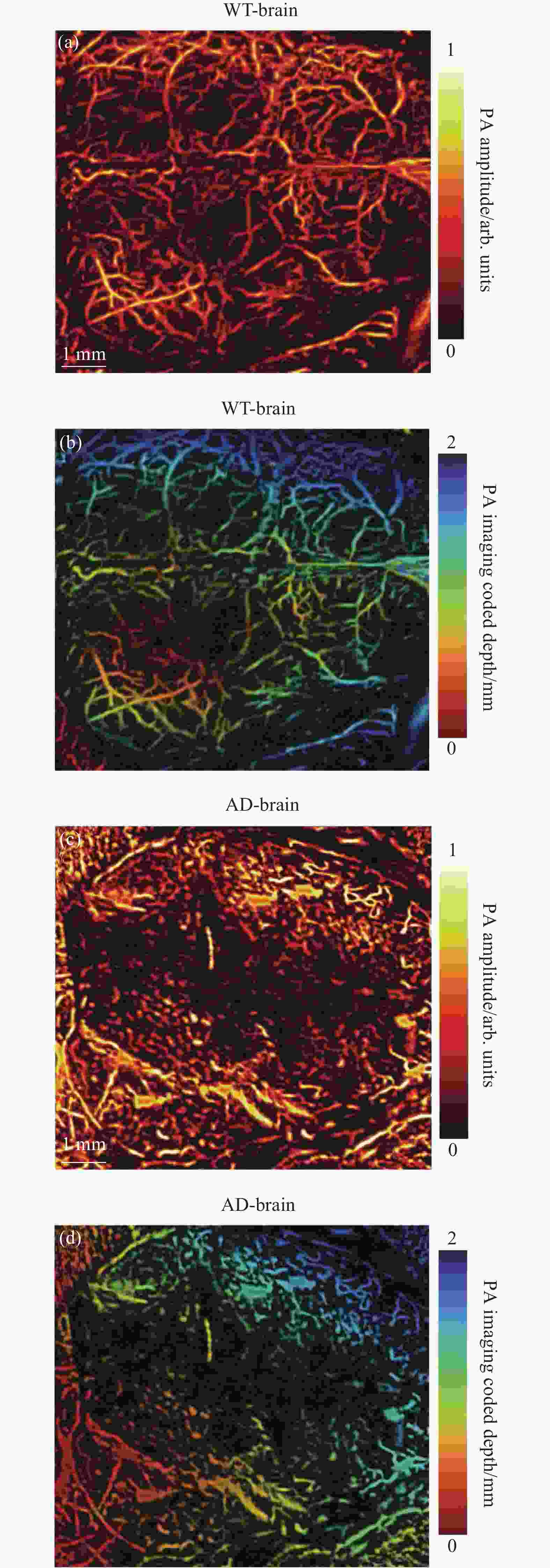
最后,利用光声成像对活体WT和AD小鼠的全脑血管进行了成像。实验是在麻醉的情况下剪开两只实验鼠的头皮并保留完整的头盖骨进行的。实验结果如图4所示,图4(a)、(b)分别为WT鼠脑血管的光声振幅成像和深度编码图像,结果展现了清晰、完整的血管网络。图4(c)、(d)分别为AD鼠脑血管的光声振幅成像和深度编码图像,图像中的血管畸形紊乱,血管网络的整体性被破坏,这一结果与AD发展中脑血管病变特征相吻合,在AD的进展中脑血管机制与氧化应激、神经炎症和β-淀粉样蛋白代谢有着千丝万缕的联系,AD进程中淀粉样斑块沉积,Tau蛋白过度磷酸化,神经炎症与脑血管粥样硬化,管腔闭塞,血管破裂,血脑屏障破坏,慢性、弥漫性皮质下缺血相互促进[19],所以到了AD后期,脑血管网络已经遭受到了巨大的破坏。对比WT/AD鼠光声脑血管成像结果可以明显发现,10月龄的AD鼠的脑血管网络已经遭到了巨大的破坏,伴有渗血,血管畸形、破裂的现象。
-
文中通过对比WT和AD鼠的脑组织切片、全脑组织、活体脑成像三个层面证明了光声成像技术可以识别AD发展导致的脑组织结构异常化区域和活体脑血管网络特征。光声成像AD鼠脑结构异质性分布的区域与PET成像AD小鼠脑斑块分布区域的结果相一致[20],但相比于PET成像,光声成像具有更高的分辨率且无需标记,成本较低和安全性更好。另一方面,光声成像AD鼠脑血管的结果与显微光学切片断层成像系统(micro-optical sectioning tomography,MOST)对AD脑血管的结果保持一致[21],但针对光学荧光成像,光声成像具有更强的深度成像能力和活体检测病变发展的优势,所以针对小动物脑疾病模型光声成像有潜力作为一种研究神经性退行性疾病病理发展的影像技术,并方便可以结合多种影像技术互补为脑科学研究提供更多维度的信息。
该系统将来可以通过升级高数值孔径的物镜和高重复频率的脉冲激光器进一步提高成像分辨率和成像速度。随着光声算法、成像速度和探测方式的进步,光声成像正快速向更深层、更快、更便携的方向发展,这意味着无论是基础研究还是临床应用光声成像技术在脑神经成像领域将发挥更大的作用。
Applications of photoacoustic technology in brain tissue imaging (invited)
-
摘要: 基于激光诱导超声机制的光声成像技术结合了光学成像的高对比度和超声成像的深穿透性,能无标记、非侵入反映生命体内源性吸收物质的分布,适合啮齿类动物模型全脑的即时成像。为了证明光声技术在脑科学研究和脑疾病监测中的应用,搭建了光声显微成像系统,其空间分辨率可达几十微米,有效成像深度可达1 mm以上,并以APP/PS1转基因阿尔茨海默症(Alzheimer’s disease, AD)模型小鼠和野生型WT小鼠为研究对象,从脑组织切片、离体全脑和活体全脑三个层面探究了光声成像在表征AD鼠和WT鼠脑结构变化和血管网络的能力,证明了光声技术在研究脑疾病发展过程中监控脑结构变化和脑血管网络特征的巨大潜力,可以为诸多脑科学研究和神经退行性疾病发展机制提供更深入的见解。Abstract: Photoacoustic imaging technology based on laser-induced ultrasound mechanism combines the high contrast of optical imaging and the deep penetration of ultrasound imaging, which can reflect the distribution of endogenous absorbents in living organisms in a label-free and non-invasive way, especially suitable for real-time imaging of the whole brain of rodent models. In order to prove the application of photoacoustic imaging technology in brain science research and brain disease monitoring, a photoacoustic microscopic imaging system with spatial resolution of tens of microns and effective imaging depth of more than 1 mm was constructed. Taking APP/PS1 transgenic Alzheimer’s disease (AD) model mice and WT mice as research objects, the ability of photoacoustic imaging in characterizing the brain structure changes and vascular network of AD mice and WT mice was explored from three levels of brain tissue slices, in vitro whole brain and in vivo whole brain. It demonstrates the great potential of photoacoustic imaging technology in monitoring brain structural changes and cerebrovascular network characteristics during the development of brain diseases, which can provide deeper insights into many brain science studies and the development mechanism of neurodegenerative brain diseases.
-
Key words:
- photoacoustic imaging /
- brain imaging /
- Alzheimer's disease /
- photoacoustic angiography
-
图 2 (a) WT鼠和AD鼠大脑组织和脑冠状切面的光学照片(蓝色虚线标注了冠状切面所在位置);(b) WT鼠和AD鼠脑组织冠状切面的光声成像;(c) WT鼠脑皮层区域光声信号幅值分布统计图;(d) AD鼠脑皮层区域光声信号幅值分布统计图
Figure 2. (a) Optical photographs of WT and AD rat brain tissue and coronal sections (blue dashed lines indicating the location of the coronal section); (b) Coronal PA imaging of WT and AD mice brain; (c) Statistical graph of amplitude distribution of PA signal in cortex of WT mouse; (d) Statistical graph of amplitude distribution of PA signal in cortex of AD mouse
图 3 (a) WT鼠和AD鼠脑组织的光学照片;(b) WT鼠和AD鼠脑组织的光声成像;(c) WT鼠和AD鼠脑组织沿图(a)蓝色虚线位置的冠状面光声成像;(d) WT鼠和AD鼠脑组织深度为0.6 mm处横断面光声成像
Figure 3. (a) Optical photograph of brain tissue of WT and AD mice; (b) PA imaging of WT and AD mice brain tissue; (c) Coronal PA imaging of WT and AD mice brain tissue along the blue dotted line in (a); (d) Transverse PA imaging at a depth of 0.6 mm in WT and AD mouse brain tissue
-
[1] Rajasekhar K, Govindaraju T. challenges and future prospects of diagnostic and therapeutic interventions in Alzheimer's disease [J]. RSC Adv, 2018, 8(42): 23780-23804. [2] Lynch C. World Alzheimer Report 2019: Attitudes to dementia, a global survey: Public health: Engaging people in ADRD research [J]. Alzheimer's & Dementia, 2020, 16: e038255. [3] Du X, Wang X, Geng M. Alzheimer's disease hypothesis and related therapies [J]. Transl Neurodegener, 2018, 7(1): 1-7. doi: 10.1186/s40035-018-0106-z [4] Johnson K A, Fox N C, Sperling R A, et al. Brain imaging in Alzheimer disease [J]. CSH Perspect Med, 2012, 2(4): a006213. [5] Ntziachristos V. Going deeper than microscopy: the optical imaging frontier in biology [J]. Nat Methods, 2010, 7(8): 603-614. doi: 10.1038/nmeth.1483 [6] Yasha Saxena, Chulhong Kim, Yao Junjie, et al. From bench to market: commercialization of photoacoustic imaging [J]. Infrared and Laser Engineering, 2017, 46(11): 1103001. doi: 10.3788/IRLA201746.1103001 [7] Na S, Russin J J, Lin L, et al. Massively parallel functional photoacoustic computed tomography of the human brain [J]. Nat Biomed Eng, 2022, 6(5): 584-592. doi: 10.1038/s41551-021-00735-8 [8] Lin L, Wang L V. The emerging role of photoacoustic imaging in clinical oncology [J]. Nat Rev Clin Oncol, 2022, 19(6): 365-384. doi: 10.1038/s41571-022-00615-3 [9] Attia A B E, Balasundaram G, Moothanchery M, et al. A review of clinical photoacoustic imaging: Current and future trends [J]. Photoacoustics, 2019, 16: 100144. doi: 10.1016/j.pacs.2019.100144 [10] Jiang D, Lan H, Wang Y, et al. Programmable acoustic delay-line enabled low-cost photoacoustic tomography system [J]. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2022: 69(6): 2075-2084. [11] Li Peng, Zhao Yang, Zhou Zhiquan, et al. Research on laser induced acoustic detection of trans-media aerial-underwater [J]. Infrared and Laser Engineering, 2021, 50(5): 20200310. (in Chinese) doi: 10.3788/IRLA20200310 [12] Zhang Z, Shi Y, Yang S, et al. Subdiffraction-limited second harmonic photoacoustic microscopy based on nonlinear thermal diffusion [J]. Opt Lett, 2018, 43(10): 2336-2339. doi: 10.1364/OL.43.002336 [13] Oraevsky A A, Jacques S L, Tittel F K. Measurement of tissue optical properties by time-resolved detection of laser-induced transient stress [J]. Appl Opt, 1997, 36(1): 402-415. doi: 10.1364/AO.36.000402 [14] Xu M, Wang L V. Universal back-projection algorithm for photoacoustic computed tomography [J]. Phys Rev E, 2005, 71(1): 016706. doi: 10.1103/PhysRevE.71.016706 [15] Wang L, Zhang C, Wang L V. Grueneisen relaxation photoacoustic microscopy [J]. Phys Rev Lett, 2014, 113(17): 174301. doi: 10.1103/PhysRevLett.113.174301 [16] Wang Q, Ding S L, Li Y, et al. The Allen mouse brain common coordinate framework: A 3D reference atlas [J]. Cell, 2020, 181(4): 936-953. doi: 10.1016/j.cell.2020.04.007 [17] Knowles T P, Vendruscolo M, Dobson C M. The amyloid state and its association with protein misfolding diseases [J]. Nat Rev Mol Cell Bio, 2014, 15(6): 384-396. doi: 10.1038/nrm3810 [18] Deture M A, Dickson D W. The neuropathological diagnosis of Alzheimer's disease [J]. Mol Neurodegener, 2019, 14(1): 32. doi: 10.1186/s13024-019-0333-5 [19] Cortes-Canteli M, Iadecola C. Alzheimer's disease and vascular aging: JACC focus seminar [J]. J Am Coll Cardiol, 2020, 75(8): 942-951. doi: 10.1016/j.jacc.2019.10.062 [20] Sehlin D, Fang X T, Cato L, et al. Antibody-based PET imaging of amyloid beta in mouse models of Alzheimer’s disease [J]. Nat Communications, 2016, 7(1): 10759. [21] Zhang X, Yin X, Zhang J, et al. High-resolution mapping of brain vasculature and its impairment in the hippocampus of Alzheimer's disease mice [J]. Natl Sci Rev, 2019, 6(6): 1223-1238. doi: 10.1093/nsr/nwz124 -






 下载:
下载: