-
光学成像技术具有无损、非接触及高分辨的特点,在生物组织三维成像方面具有独特优势。当前,用于生物组织三维成像的光学成像技术主要有激光共聚焦层析成像技术[1](Laser Confocal Tomography, LCT)、光学相干层析成像技术(Optical Coherence Tomography, OCT)[2]、超声调制光学层析成像技术[3](Ultrasound-modulated Optical Tomography, UOT)、光声层析成像技术[4-5](Photoacoustic Tomography, PAT)。
激光共聚焦层析成像技术主要用于科学研究,进行细胞级别的生物三维成像,其横向分辨力突破衍射极限1.4倍,通常优于2 μm[6]。纵向分辨力取决于离焦曲线半高宽,在几十微量级,通过离焦曲线线性段标定,可获得优于1 μm的纵向分辨力,但激光共聚焦层析成像技术成像深度较浅,对于荧光染色和透明化处理后的生物样品,成像深度可达200 μm以上,但对于未进行处理的生物组织,成像深度通常低于100 μm。光学相干层析成像技术是一项新近发展的生物医学三维成像技术,通过低相干光干涉实现层析成像,目前已被应用于眼底病变检查、心脏冠状动脉成像和乳腺癌早期检测[7],该技术横向分辨力通常为3 ~ 10 μm,纵向分辨力为7 ~ 20 μm,成像深度1 ~ 2 mm[8]。超声调制光学层析成像技术(UOT)和光声层析成像技术(PAT)属于声光相互作用的成像模式,虽然成像深度均达到厘米量级,但分辨率受限于超声换能器,通常仅有0.5 ~ 1 mm左右。对比上述四项技术可以看出,在生物组织三维成像领域成像分辨率和成像深度难以兼顾,特别是对于厚组织样品的较大深度的细胞级三维成像存在较大困难。
激光移频回馈技术(Laser frequency-shifted feedback)又称激光自混合干涉技术(Laser self-mixing interference)是一种新型的干涉技术,具有极高的探测灵敏度,该项技术应用于生物组织成像具有显著的优势。2013年,清华大学谈宜东课题组将激光移频回馈技术和共聚焦层析成像技术相结合,提出了激光器回馈共聚焦层析成像(Laser Feedback Confocal Tomography, LFCT)技术[9]。该技术在继承共聚焦层析成像技术的层析能力和非焦面噪声抑制能力的同时,还具有极高的灵敏度和纵向分辨力,在探测微弱信号领域方面具有优势。目前,该项技术主要应用于高分辨率的表面形貌测量、MEMS器件的内部成像及生物组织内部金属异物的定位[10],未见生物组织细胞级成像报道。
文中详细介绍了研制的激光回馈共聚焦层析成像系统。硬件方面,该系统可获得突破衍射极限1.4倍的横向分辨力,在使用
$NA = 0.42$ 的显微物镜时,横向分辨力约为1.1 μm,纵向分辨力约为19.4 μm,在进行离焦曲线线性段标定后,可获得与轴向位移台精度一致的纵向分辨力。软件方面,设计了基于LabVIEW的三维定位与扫描采集模块和基于Matlab的三维图像重建模块,可对待测区域进行精确定位,进而获得待测区域三维层析图像,具有相当的实际应用价值。最后,展示了基于该系统获得的活体生物组织二维和三维层析成像结果。 -
激光回馈共聚焦层析成像原理示意图如图1(a)所示,激光束经成像系统聚焦于待测样品,形成光学探针。经外部物体反射或散射的移频光进入激光谐振腔,引起激光器输出功率的剧烈变化,这种变化与返回谐振腔的光子数相关,可以直接反映待测样品信息,通过探针扫描,可获得待测样品的二维、三维层析图像。图1(a)可以等效为图1(b)所示的激光共聚焦层析成像系统,在该系统中,信号光需要进入激光谐振腔才能产生激光回馈效用,微片激光器既充当了光源又充当了实际的探测器,因此成像系统是自准直的。同时,微片激光器本身的激光束腰充当虚拟针孔,杂散光无法沿束腰入射至激光器,不会引发回馈效应,实现了虚拟共聚焦,可以在不使用空间滤波器的情况下获得极高横向、纵向分辨力。另外,声光移频器的设置也为该项技术带来独特的优势:一方面,移频频率接近微片激光器弛豫振荡频率时可以获得极高的放大倍数;另一方面,类似外差干涉法的系统设置使得激光回馈共聚焦层析成像系统光路部分具有良好的稳定性。

图 1 (a)激光回馈共聚焦层析成像原理和(b)等效共聚焦系统
Figure 1. (a) Principle diagram of LFCT and (b) equivalent confocal system
激光回馈共聚焦层析成像技术的高灵敏度来自于激光移频回馈效应。在声光移频器调制频率为
$\varOmega $ 的条件下,其探测器所检测到的输出功率的相对调制为:$$\begin{split} &\dfrac{{\Delta I\left( {2\varOmega } \right)}}{{{I_S}}} = \kappa I\left( u \right)G\left( {2\varOmega } \right)\cos \left( {2\varOmega t - \phi - {\phi _s}} \right)\\ &G\left( {2\varOmega } \right) = 2{\gamma _c}\sqrt {\dfrac{{{\eta ^2}{\gamma ^2} + {{\left( {2\varOmega } \right)}^2}}}{{{\eta ^2}{\gamma ^2}{{\left( {2\varOmega } \right)}^2} + {{\left( {{\omega _r}^2 - {{\left( {2\varOmega } \right)}^2}} \right)}^2}}}} \end{split}$$ (1) 式中:
$\Delta I$ 为表示激光器功率的调制信号;${I_S}$ 为稳态输出功率;$\kappa $ 为样品的反射率;$G(2\varOmega )$ 是微片激器移频回馈效应所产生的增益;${\phi _s}$ 为固定的附加相位;$\phi $ 为外腔回馈相位,反映了外腔长变化;$\eta {\rm{ = }}{N_0}{\rm{/}}N$ 为相对泵浦水平,是实际泵浦功率和阈值泵浦功率的比值;${\omega _r} = {({\gamma _c}\gamma \pi (\eta - 1))^{1/2}}$ 为微片激光器的弛豫振荡频率。增益系数$G(2\varOmega )$ 的大小与移频频率$2\varOmega $ 和弛豫振荡频率${\omega _r}$ 有关,当$2\varOmega = {\omega _r}$ 时,$G(2\varOmega )$ 取到最大值,可以达到106量级[11-13]。 -
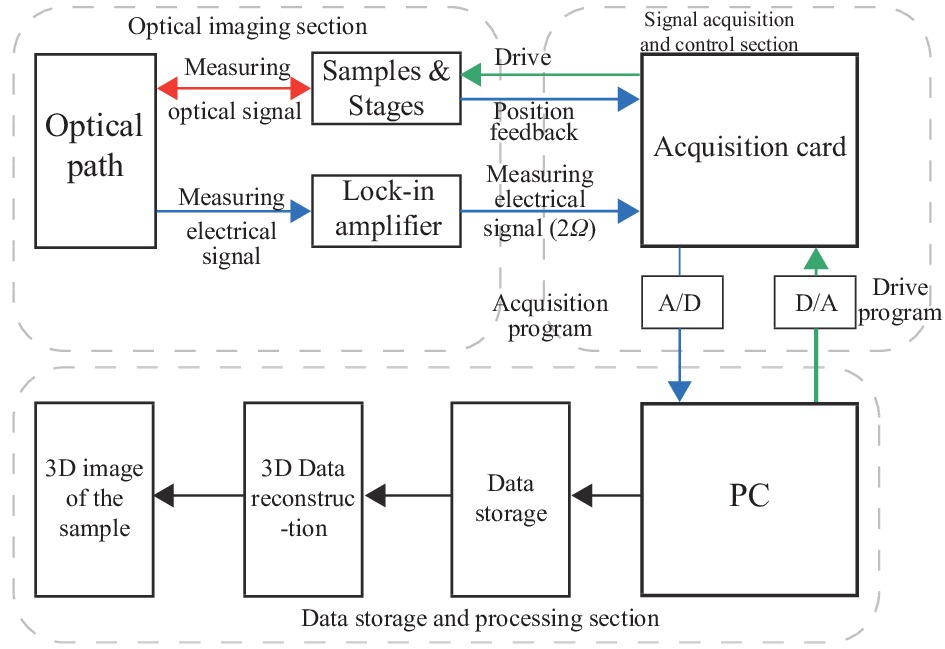
基于上述激光回馈共聚焦层析成像原理,搭建了一套具有实际应用价值的激光回馈共聚焦层析成像系统,该系统总体结构示意图如图2所示,分为光学成像模块、信号采集和扫描控制模块、数据存储与处理模块三部分。光学成像模块用于提供高信噪比的成像信号,信号扫描采集和控制模块用于位移台扫描控制和信号采集,数据存储与处理模块用于数据存储、预处理及三维图像重建。
-
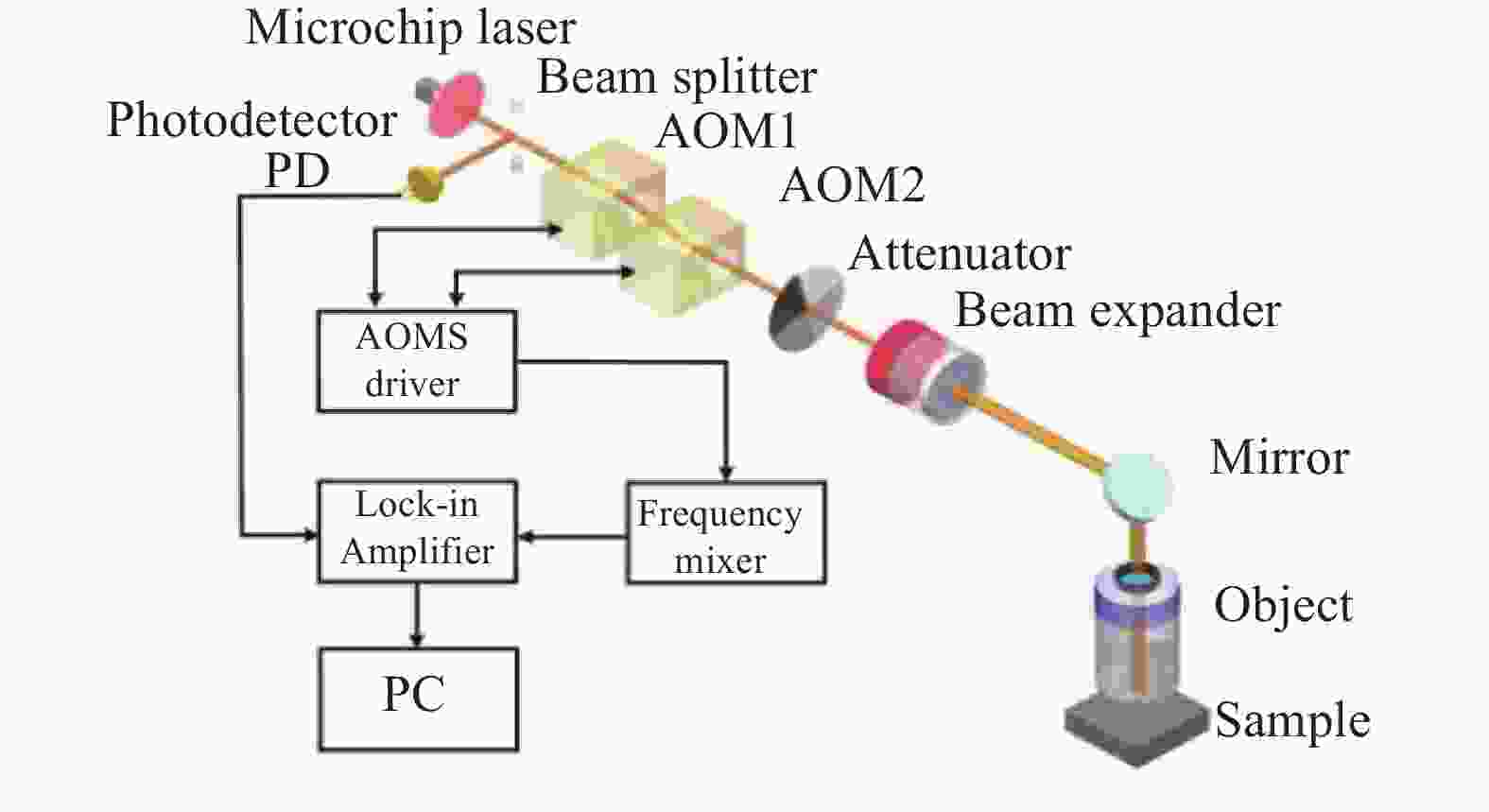
激光回馈共聚焦层析成像系统光学成像模块如图3所示。光源使用a-cut Nd:YVO4微片激光器,微片厚度0.75 mm,由波长808 nm的激光二极管泵浦,实现单纵模线偏振输出,输出激光波长为1 064 nm。微片激光器输出的光束经过分束比为1∶1的分束镜(Beam Splitter)分为两部分,第一部分进入光电探测器(PD)用于信号探测和解调,第二部分进入成像光路进行扫描成像。在成像光路中,两个声光移频器(AOM)以差分结构排列,AOM1的驱动频率为
${\omega _1} = 70\;{\rm{MHz}}$ ,AOM2的驱动频率为${\omega _2} = 71\;{\rm{MHz}}$ 。光束依次通过AOM1、 AOM2,产生的频移为$\varOmega = \left| {{\omega _1}{\rm{ - }}{\omega _2}} \right| = {\rm{1\;MHz}}$ 。而后光束经过扩束比为10×的扩束镜(Beam Expander)扩束后,由50×近红外物镜(Object)聚焦到样品的表面或内部,物镜工作距为20.4 mm,数值孔径$NA{\rm{ = 0}}{\rm{.42}}$ 。AOM2与扩束镜之间设置衰减片用于防止强回馈现象发生。样品反射光沿入射路径返回至激光谐振腔,经两次移频后的移频频率为$2\varOmega = 2\;{\rm{MHz}}$ ,对激光器输出光产生频率为$2\varOmega $ 的光强调制。光电探测器(PD)输出的测量信号和混频器产生的参考信号同时输入锁相放大器(Lock-in Amplifier)进行解调,锁相放大器选择放大得到$2\varOmega = 2\;{\rm{MHz}}$ 处的信号强度。待测样品置于高精度三维位移台上,通过位移台移动实现三维扫描。 -
光电探测器的信号输入至锁相放大器进行放大,输出信号由LabVIEW程序驱动采集卡采集后输入到计算机[14-15]。LFCT系统采用电控位移台逐点扫描的方式,在步进扫描同时进行数据采集,采用一维连续扫描与二维度步进相结合的数据采集方式:位移台步进时改变对应样品位置,位移台连续扫描时采集扫描数据。
-
计算机输出的数字信号由采集卡D/A转换后生成模拟信号,分别驱动三个维度上的位移平台。为了提高扫描效率、降低扫描时长,系统采用了不复位连续扫描的方式,如图4所示。若以X–Y平面进行三维扫描当中的数据采集平面,当二维扫描时,沿X或Y方向作为步进,在另一方向上进行连续扫描采集,扫描结束后,对连续扫描得到的数据点进行数据重建,得到纵切面或横切面图。以沿光轴(Z)方向作为三维扫描当中的步进方向进行步进,X–Y平面进行上述相同形式的二维扫描采集操作,当每一层X–Y平面的图像采集完成后,进行二维层析图像的叠加,得到样品扫描的三维图样。
只要设定好每个步进维度上的方向、步距、总距离和每个连续扫描维度上的方向、速度、总距离,就能够完成目标物体的三维扫描及数据采集。
由于采用了位移台机械扫描的方式,成像速度相对较低,如若以X轴方向2 mm/s的扫描速度,Y、Z轴步进距离5 μm的参数设置,精细扫描一块2 mm×2 mm×0.1 mm三维立体的区域,扫描时间要约2.2 h。
-
活体生物组织的三维成像,对于成像的时效性要求较高。为保证扫描数据的有效性和扫描数据的精细度,采用了大范围粗略扫描和小范围精细扫描相结合的扫描方式,便于定位目标区域,降低扫描时间。对于大范围区域,采用降低采样频率、提高扫描速度、增加步进距离的方式提高扫描时间和降低数据量。对于需要精细观察的小范围区域,采用高采样频率、低扫描速度、小步进距离的方式扫描。另外,为进一步降低光轴方向数据量和扫描工作量,设计了Z轴定位模块,在开始三维扫描之前,首先检测待测目标上表面和轴向各个分界面,便于对扫描起始位置进行快速定位,工作流程如图5所示。
Z轴定位模块先对待测物体进行一定大范围内扫描,获得扫描曲线。当光探针穿过介质分界面时,扫描曲线会对应出现离焦曲线,且曲线峰值位置对应分界面表面。初步定位过程中涵盖了所有分界面对应的离焦曲线,根据目标界面位置处峰值及其曲线宽度设置限制条件,进行波峰位置检测,得到峰值对应位置信息。驱动平台缩进到达目标峰值位置,确认定位后进入下层采集模块设置三个维度对应的采集范围、速度、方向等参数,开始采集。
三维扫描程序代码如图6所示。利用LabVIEW程序中的图形化界面配置DAQ助手可实现位移台方向的控制,创建NI-DAQmx虚拟通道用于驱动及控制位移台的运动速度和距离。DAQ助手无需编程,仅通过图形化界面配置就能够实现数据采集任务。在本系统中,DAQ助手连续采集平台采集到的数据写入至测量文件,输出测量文件为文文中件。图2中信号采集与驱动部分驱动三个维度的位移平台,各维度的位移台驱动及控制程序均由图6所示程序代码构成,并将其嵌套进条件结构与For循环结构中,从而实现三维驱动步进与连续采集相结合。不同的是,当任一维度处于步进状态时,该顺序结构中DAQ助手采集到的数据无需写入测量文件。
-
三维机械扫描并不能直接获得三维数据,数据采集过程实际进行了数据降维,测量后输出的文件中仅能获得一维数据。由于系统采用了不复位的连续扫描方式,导致偶数次与奇数次扫描的二维层析图像在步进方向与扫描初始方向上均完全相反,因此在图像重建之前需要进行数据预处理。
数据预处理时,首先将一维的数据点按层数分块,而后每层按照扫描逆过程重新排列,形成各层二维矩阵。以X轴方向连续扫描、Y轴方向步进为例,二维矩阵的行数为X轴扫描点个数,列数为Y轴步进次数。而后对二维矩阵进行归一化处理,将数据规范到[0, 1]范围内,便于后续数据处理。其次将各层二维矩阵合并为三维矩阵,此时需要以奇数次(即以初始方向的X、Y轴位移台运动方向)扫描得到的二维层析图像为基准,将得到的偶数次层析图像进行翻转,再与奇数次层析图像堆叠,输出结果。三维矩阵中x维度对应二维行数,y维度的大小由Y轴向步进次数给出,z维度的大小为Z轴步进次数。
获得的三维图像直接显示时,各层图像间相互遮挡,无法直观显示内部结构,为了清晰直观地反映重建后的三维图像,设计了切片图和等值面图两种三维图像重建显示方式。切片图用于从三维数据中提取X、Y、Z任意方向的切面图像,显示方式较为简单,处理基本流程为建立网格、提取切面图像、设置图像透明度。等值面图可以较为直观地显示内部结构轮廓,其程序框图如图7所示。
-
在完成激光回馈共聚焦层析成像系统搭建后,对成像系统的横、纵向分辨力进行了计算和测量。在激光回馈共聚焦层析成像技术中光源和探测器均为激光器,激光器束腰充当探测前的空间针孔滤波器,该系统满足共聚焦成像系统的构成条件,实现了虚拟共聚焦。因此激光回馈共聚焦层析成像的横向分辨力与激光共聚焦层析成像相当,为普通光学成像系统的1.4倍[5-8],其横向分辨力由物镜数值孔径与激光器波长决定:
$$\Delta x = \dfrac{{0.61\lambda }}{{\sqrt 2 NA}}$$ (2) 实验系统中50倍近红外物镜的数值孔径
$NA{\rm{ = 0}}{\rm{.42}}$ ,激光的波长λ = 1 064 nm,代入公式(2)可得入实验系统的理论横向分辨力为$\Delta x \approx \;$ 1.09 μm。为了测定系统的实际分辨力,对一块周期为3.0 μm,台阶高度约500 nm的标准刻划光栅的台阶结构进行了测试。实验结果如图8(a)所示,系统能明显分辨台阶的上下表面,表明该系统用于表面形貌测量时纵向分辨力优于500 nm。通过对刻划光栅的阶跃边缘的成像进行分析可以得到系统的横向分辨力为1.1 μm,结果与理论横向分辨力一致。
图 8 (a)激光回馈共聚焦层析成像的刻划光栅测量结果;(b)LFCT的离焦响应曲线
Figure 8. (a) Ruled grating measurement result of LFCT; (b) Defocus responding curve of LFCT
系统的纵向分辨力则根据离焦响应曲线的半高宽(FWHM)给出,以一块5 mm厚度的K9玻璃作为待测物体,沿光轴方向一维扫描K9玻璃的上表面,行程长度为200 μm,实验结果如图8(b)所示。计算得曲线的半高宽为FWHM = 19.4 μm,对应的实验系统纵向分辨力为19.4 μm。
-
为了验证激光回馈共聚焦层析成像系统的生物组织成像能力,取新鲜洋葱内表皮制成切片样本固定在位移平台上,定位至上表面位置后开始层析扫描与数据采集,扫描范围为300 μm×600 μm,扫描深度为80 μm,获得40层二维层析图像。
经过三维数据重建后,图9给出了激光回馈共聚焦层析成像系统对洋葱表皮切片的探测结果,在这幅图像中可以清晰地观察到洋葱表皮细胞分界以及细胞壁的排列结构。图9(a)所示为同一新鲜洋葱内表皮制成切片样本在暗视场显微镜下的图像,图9(b)为激光回馈共聚焦层析成像系统获得三维图像,箭头所示方向为光轴方向(Z方向)。由于三维图像直接显示时,各层图像间相互遮挡,无法直观显示内部结构,为了清晰直观地反映重建后的三维图像,重建了切片图和等值面图两种三维图像,如图9(c)和图9(d)所示。
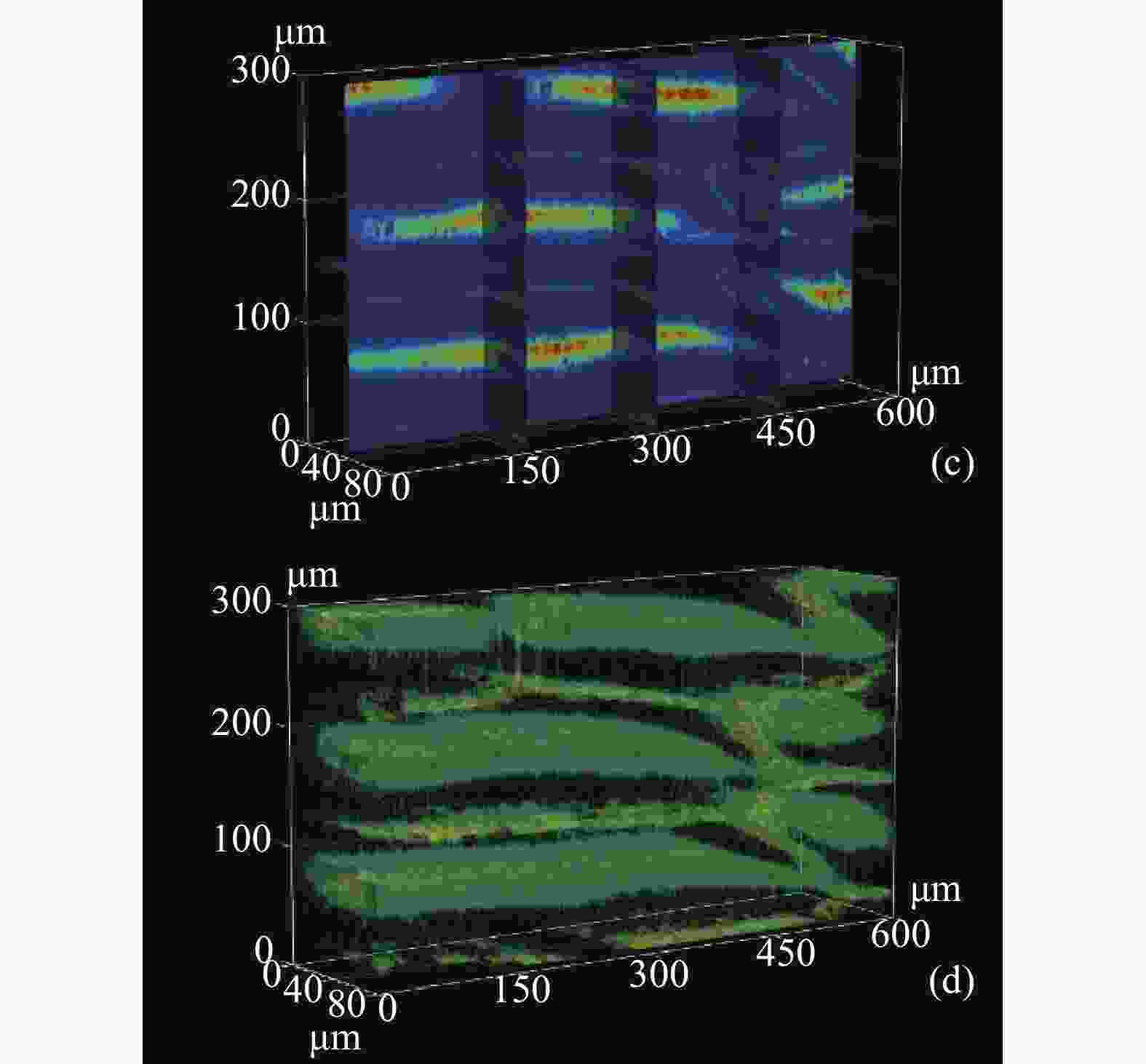
图 9 新鲜洋葱内表皮组织激光回馈共聚焦层析图像和暗视场显微镜图像 。(a) 暗视场显微图像; (b) 三维激光回馈共聚焦层析图像; (c) 激光回馈共聚焦层析成像切片图 ;(d) 激光回馈共聚焦层析成像等值线图
Figure 9. LFCT image and dark field microscope image of fresh onion innerepidermal tissue. (a) Image of dark field microscopic; (b) 3D image of LFCT; (c) Slice map of LFCT; (d) Contour map of LFCT
图10给出了激光回馈共聚焦层析成像系统对于未处理的新鲜洋葱组织内部500 μm成像深度的大范围扫描图像,证明激光回馈共聚焦层析成像技术可以在保持高分辨率的同时获得较大的成像深度。相比传统激光共聚焦层析成像系统,对于未进行荧光染色和透明化处理的组织,成像深度有所突破。
-
文中设计并搭建了基于激光回馈共聚焦的层析成像系统,并将该系统应用于生物组织细胞级三维成像上,能够清晰地观测到细胞的结构信息,证明了激光回馈共聚焦层析成像技术在生物组织显微成像领域的应用价值和发展潜力。搭建的激光回馈共聚焦层析成像系统横向分辨力约1.09 μm,用于介质内部成像时纵向分辨力约19.4 μm,用于表面形貌测量时纵向分辨力优于500 nm。设计了基于LabVIEW的三维定位与扫描采集模块和基于Matlab的三维图像重建模块,可对待测区域进行精确定位,重构待测目标三维层析图像,并获得任意方向的切面图像。
Tomography system based on laser feedback confocal
-
摘要: 激光回馈共聚焦层析成像技术因其极高的灵敏度和纵向分辨力而被应用于高分辨率的表面形貌测量、MEMS器件的内部成像,并可对生物组织内部金属异物进行定位,然而至今未曾有过对于生物组织细胞级别成像的报道。设计并搭建了基于激光回馈共聚焦层析成像技术的三维成像系统,对活体生物组织进行了探测和图像重建,能够清晰地观测到细胞的结构信息,证明了激光回馈共聚焦层析成像技术在生物组织成像领域的应用价值和发展潜力。三维成像系统可获得突破衍射极限1.4倍的横向分辨力,在使用
$NA = 0.42$ 的显微物镜时,横向分辨力约为1.1 μm,纵向分辨力约为19.4 μm,用于表面形貌测量时纵向分辨力优于500 nm。同时,设计了基于LabVIEW软件三维定位与扫描采集模块和基于Matlab软件的三维图像重建模块,可对待测区域进行精确定位,进而获得待测区域三维层析图像,具有相当的实际应用价值。Abstract: Laser feedback confocal tomography was used for high-resolution surface topography measurement, internal imaging of MEMS devices due to its extremely high sensitivity and longitudinal resolution, and can locate metal foreign objects in biological tissues. However, so far no cell-level imaging of biological tissues has ever been performed. A three-dimensional imaging system based on laser feedback confocal tomography was designed and built. The living tissue was detected and reconstructed, and the structure information of the cells can be clearly observed, which can prove its application value and development potential of technology in the field of biological tissue imaging. The three-dimensional imaging system can obtain a lateral resolution of 1.4 times the diffraction limit. When a microscope objective lens with$NA = 0.42$ was used, the lateral resolution was about 1.1 microns and the longitudinal resolution was 19.4 μm. It was used for surface topography measurement better than 500 nm.At the same time, a 3D positioning and scanning acquisition module based on LabVIEW software and a 3D image reconstruction module based on Matlab software were designed to accurately locate the area to be measured, and then obtain a 3D tomographic image of the area to be measured, which has considerable practical application value. -
图 9 新鲜洋葱内表皮组织激光回馈共聚焦层析图像和暗视场显微镜图像 。(a) 暗视场显微图像; (b) 三维激光回馈共聚焦层析图像; (c) 激光回馈共聚焦层析成像切片图 ;(d) 激光回馈共聚焦层析成像等值线图
Figure 9. LFCT image and dark field microscope image of fresh onion innerepidermal tissue. (a) Image of dark field microscopic; (b) 3D image of LFCT; (c) Slice map of LFCT; (d) Contour map of LFCT
-
[1] Minsky M. Memoir on inventing the confocal scanning microscope [J]. Scanning, 1988, 10(4): 128-138. doi: 10.1002/sca.4950100403 [2] 张芹芹, 吴晓静, 朱思伟, 等. 谱域光学相干层析成像量化技术及其在生物组织定量分析中的应用[J]. 光学 精密工程, 2012, 20(6): 1188-1193. doi: 10.3788/OPE.20122006.1188 Zhang Qinqin, Wu Xiaojing, Zhu Siwei, et al. Quantitative spectral domain optical coherence tomography and its application to quantitative analysis of biological tissues [J]. Optics and Precision Engineering, 2012, 20(6): 1188-1193. (in Chinese) doi: 10.3788/OPE.20122006.1188 [3] Hussain A, Steenbergen W, Vellekoop I M. Imaging blood flow inside highly scattering media using ultrasound modulated optical tomography [J]. Journal of Biophotonics, 2018, 11(1): e201700013. doi: 10.1002/jbio.201700013 [4] Kim J, Lee D, Jung U, et al. Photoacoustic imaging platforms for multimodal imaging [J]. Ultrasonography, 2015, 34(2): 88-97. doi: 10.14366/usg.14062 [5] 苗少峰, 杨虹, 黄远辉, 等. 光声成像研究进展[J]. 中国光学, 2015, 8(5): 699-713. doi: 10.3788/co.20150805.0699 Miao Shaofeng, Yang Hong, Huang Yuanhui, et al. Research progresses of photoacoustic imaging [J]. Chinese Optics, 2015, 8(5): 699-713. (in Chinese) doi: 10.3788/co.20150805.0699 [6] 张运海, 杨皓旻, 孔晨晖. 激光扫描共聚焦光谱成像系统[J]. 光学 精密工程, 2014, 22(6): 1446-1453. doi: 10.3788/OPE.20142206.1446 Zhang Yunhai, Yang Haomin, Kong Chenhui. Spectral imaging system on laser scanning confocal microscopy [J]. Optics and Precision Engineering, 2014, 22(6): 1446-1453. (in Chinese) doi: 10.3788/OPE.20142206.1446 [7] 蔡怀宇, 张玮茜, 陈晓冬, 等. 眼科光学相干层析成像的图像处理方法[J]. 中国光学, 2019, 12(4): 731-740. doi: 10.3788/co.20191204.0731 Cai Huaiyu, Zhang Weiqian, Chen Xiaodong, et al. Image processing method for ophthalmic optical coherence tomography [J]. Chinese Optics, 2019, 12(4): 731-740. (in Chinese) doi: 10.3788/co.20191204.0731 [8] Jonas Olsen, Jon Holmes, Gregor B. Advances in optical coherence tomography in dermatology- A review [J]. Journal of Biomedical Optics, 2018, 23(4): 1-10. [9] Tan Y, Wang W, Xu C, et al. Laser confocal feedback tomography and nano-step height measurement [J]. Scientific Reports, 2013, 3: 2971. doi: 10.1038/srep02971 [10] Zhu K, Chen H, Zhang S, et al. Frequency-shifted optical feedback measurement technologies using a solid-state microchip laser [J]. Applied Sciences, 2019, 9(1): 109. [11] 周博睿, 谈宜东, 沈学举, 等. 微泡造影剂增强超声调制激光回馈成像对比度的机理研究[J]. 物理学报, 2019, 68(21): 172-181. Zhou Borui, Tan Yidong, Shen Xueju, et al. Mechanism of contrast-enhancement in ultrasound-modulated laser feedback imaging with ultrasonic microbubble contrast agent [J]. Acta Physica Sinica, 2019, 68(21): 172-181. (in Chinese) [12] Zhu K, Guo B, Lu Y, et al. Single-spot two-dimensional displacement measurement based on self-mixing interferometry [J]. Optica, 2017, 4(7): 729-735. doi: 10.1364/OPTICA.4.000729 [13] Lu Y, Zhu K, Li J, et al. Depth of focus extension by filtering in the frequency domain in laser frequency-shifted feedback imaging [J]. Applied Optics, 2018, 57(20): 5823-5830. doi: 10.1364/AO.57.005823 [14] 张来线, 孙华燕, 樊桂花, 等. 基于LabVIEW的高性能激光主动探测控制与处理系统设计[J]. 红外与激光工程, 2013, 42(12): 3239-3244. doi: 10.3969/j.issn.1007-2276.2013.12.015 Zhang Laixian, Sun Huayan, Fan Guihua, et al. High efficiency laser active detection controlling and processing system design based on LabVIEW [J]. Infrared and Laser Engineering, 2013, 42(12): 3239-3244. (in Chinese) doi: 10.3969/j.issn.1007-2276.2013.12.015 [15] 黄敬霞, 张斌. 激光散射显微镜的自动检测系统[J]. 红外与激光工程, 2007, 36(z1): 274-276. Huang Jingxia, Zhang Bin. Automatic checkout system of the laser scattering microscope [J]. Infrared and Laser Engineering, 2007, 36(z1): 274-276. (in Chinese) -








 下载:
下载: